Ти вже знаєш, що хімічне рівняння — умовний запис хімічної реакції за допомогою хімічних формул. Його складають на основі закону збереження маси речовин, згідно з яким маса речовин, що вступають у реакцію, дорівнює масі речовин, що утворюються внаслідок реакції. Добираючи коефіцієнти до формул речовин, ти зрівнюєш число атомів кожного елемента в лівій і правій частинах і дістаєш хімічне рівняння, що відповідає закону збереження маси.
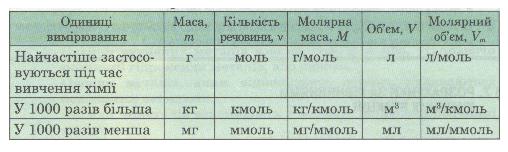
Пам'ятай! Для розрахунків важливо обирати такі одиниці вимірювання маси, об'єму, кількості речовини, які відповідають одна одній
За хімічним рівнянням можна робити різні розрахунки — обчислювати кількість речовини, масу, об'єм вихідних речовин або продуктів реакції. Для цього потрібно спочатку записати скорочену умову задачі, правильно використовуючи фізичні величини і їх позначення (табл. 2).
Пам'ятай! Для розрахунків важливо обирати такі одиниці вимірювання маси, об'єму, кількості речовини, які відповідають одна одній
За хімічним рівнянням можна робити різні розрахунки — обчислювати кількість речовини, масу, об'єм вихідних речовин або продуктів реакції. Для цього потрібно спочатку записати скорочену умову задачі, правильно використовуючи фізичні величини і їх позначення (табл. 2).
Рівняння хімічної реакції дає змогу здійснювати розрахунки маси, об'єму або кількості речовини вихідних речовин чи продуктів реакції.
Розглянемо конкретні приклади.
Приклад 1. Яку масу гашеного вапна Са(ОН)2 можна добути внаслідок взаємодії з водою кальцій оксиду масою 280 г?
Передусім запиши скорочену умову задачі та склади рівняння хімічної реакції.
Дано:
m(СаО) = 280 г
m(Са(ОН)2) — ?
Розв'язування:
СаО + Н2О = Са(ОН)2
Варіант 1
Прочитай ще раз умову задачі та підкресли відоме (що дано) і невідоме (що треба взнати). Над підкресленими формулами простав вихідні дані з умови задачі:
280 г х
СаО + Н2О = Са(ОН)2
Прочитай ще раз умову задачі та підкресли відоме (що дано) і невідоме (що треба взнати). Над підкресленими формулами простав вихідні дані з умови задачі:
280 г х
СаО + Н2О = Са(ОН)2
Під формулами речовин запиши дані, які можна дістати з рівняння реакції:
280 г х
СаО + Н2О = Са(ОН)2
_______________ __________________
280 г х
СаО + Н2О = Са(ОН)2
_______________ __________________
М= 40 + 16 = 56 г/моль М= 40 + 32 + 2 = 74 г/мольv = 1 моль v = 1 моль
m = 1 моль•56 г/моль = 56 г m = 1 моль•74 г/моль = 74 г
Розв'язання задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин
З рівняння реакції виходить, що внаслідок взаємодії з водою 56 г СаО можна добути 74 г гашеного вапна Са(ОН)2, а якщо взяти не 56 г, а 280 г СаО, то можна добути гашеного вапна у стільки разів більше, у скільки 280 г більше за 56 г. Тобто ти бачиш, що між величинами існує пряма пропорційна залежність. Отже, ти можеш скласти пропорцію і розв'язати її:
56 г : 280 г = 74 г : х;
x = (280 г • 74 г)/(56 г) = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Варіант 2
СаО + Н2О = Са(ОН)2
___________ ________________
m = 1 моль•56 г/моль = 56 г m = 1 моль•74 г/моль = 74 г
Розв'язання задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин
З рівняння реакції виходить, що внаслідок взаємодії з водою 56 г СаО можна добути 74 г гашеного вапна Са(ОН)2, а якщо взяти не 56 г, а 280 г СаО, то можна добути гашеного вапна у стільки разів більше, у скільки 280 г більше за 56 г. Тобто ти бачиш, що між величинами існує пряма пропорційна залежність. Отже, ти можеш скласти пропорцію і розв'язати її:
56 г : 280 г = 74 г : х;
x = (280 г • 74 г)/(56 г) = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Варіант 2
СаО + Н2О = Са(ОН)2
___________ ________________
v = 1 моль v = 1 моль
М= 40 + 16 = 56 г/моль М= 40 + 32 + 2 = 74 г/моль
Обчисли, яку кількість речовини становлять 280 г.
v = m/M; v(CaO)=(280 г)/(56 г/моль) = 5 моль.
З рівняння реакції видно, якщо взаємодіє з водою кальцій оксид кількістю речовини 1 моль, то й утворюється кальцій гідроксид кількістю речовини 1 моль.
Отже, якщо в реакцію вступає кальцій оксид кількістю речовини 5 моль, то й утвориться кальцій гідроксид кількістю речовини 5 моль, тобто:
m = v • М.
m(Са(ОН)2) = 5 моль • 74 г/моль = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Приклад 2. Яка кількість речовини нітроген(V) оксиду прореагувала з водою, якщо утворилася нітратна кислота HNО3 кількістю речовини 10 моль?
Дано:
М= 40 + 16 = 56 г/моль М= 40 + 32 + 2 = 74 г/моль
Обчисли, яку кількість речовини становлять 280 г.
v = m/M; v(CaO)=(280 г)/(56 г/моль) = 5 моль.
З рівняння реакції видно, якщо взаємодіє з водою кальцій оксид кількістю речовини 1 моль, то й утворюється кальцій гідроксид кількістю речовини 1 моль.
Отже, якщо в реакцію вступає кальцій оксид кількістю речовини 5 моль, то й утвориться кальцій гідроксид кількістю речовини 5 моль, тобто:
m = v • М.
m(Са(ОН)2) = 5 моль • 74 г/моль = 370 г.
Відповідь. Унаслідок взаємодії з водою кальцій оксиду масою 280 г, можна добути гашене вапно Са(ОН)2 масою 370 г (m(Са(ОН)2) = 370 г).
Приклад 2. Яка кількість речовини нітроген(V) оксиду прореагувала з водою, якщо утворилася нітратна кислота HNО3 кількістю речовини 10 моль?
Дано:
v(HNО3) = 10 моль
v(N2О5) — ?
Розв'язування:
х 10 моль
N205 + Н20 = 2HN03
1 моль : х = 2 моль : 10 моль;
х = (1 моль • 10 моль)/(2 моль) = 5 моль
v(N2О5) — ?
Розв'язування:
х 10 моль
N205 + Н20 = 2HN03
1 моль : х = 2 моль : 10 моль;
х = (1 моль • 10 моль)/(2 моль) = 5 моль
Відповідь. Якщо утворилася нітратна кислота HN03 кількістю речовини 10 моль, то з водою прореагував нітроген(V) оксид кількістю речовини 5 моль (v(N205) = 5 моль).
Приклад 3. Магній масою 3 г взаємодіє з киснем. Яка кількість речовини магній оксиду утвориться при цьому?
Дано:
Приклад 3. Магній масою 3 г взаємодіє з киснем. Яка кількість речовини магній оксиду утвориться при цьому?
Дано:
m(Mg) = 3 г
v(MgO) — ?
Розв'язування:
З г х
2Mg + 02 = 2MgO
v= 2 моль v = 2 моль
Оскільки відносно магнію виявились різні одиниці вимірювання (грами і молі), треба визначити, яку кількість речовини становлять 3 г магнію:
n = m/M M(Mg) = 24 г/моль;
v(Mg) = (3 г)/(24 г/моль) = 0,125 моль
Рівняння реакції показує, якщо у взаємодію з киснем вступає 2 моль магнію, то утворюється 2 моль MgO. Отже, якщо в реакцію вступає 0,125 моль Mg, то й утворюється 0,125 моль MgO.
v(MgO) — ?
Розв'язування:
З г х
2Mg + 02 = 2MgO
v= 2 моль v = 2 моль
Оскільки відносно магнію виявились різні одиниці вимірювання (грами і молі), треба визначити, яку кількість речовини становлять 3 г магнію:
n = m/M M(Mg) = 24 г/моль;
v(Mg) = (3 г)/(24 г/моль) = 0,125 моль
Рівняння реакції показує, якщо у взаємодію з киснем вступає 2 моль магнію, то утворюється 2 моль MgO. Отже, якщо в реакцію вступає 0,125 моль Mg, то й утворюється 0,125 моль MgO.
Відповідь. Якщо з киснем взаємодіє магній масою 3 г, то утворюється магній оксид MgO кількістю речовини 0,125 моль (v(MgO) = 0,125 моль).



 —
—  —
—  — в осад випадає
— в осад випадає  — в осад випадає
— в осад випадає  — в осад випадає
— в осад випадає _2 + 4H_2O }](https://wikimedia.org/api/rest_v1/media/math/render/svg/562dec45d134f2400e008dd1d0ae03adaf70cb25) —
—  —
—  β глюкоза
β глюкоза